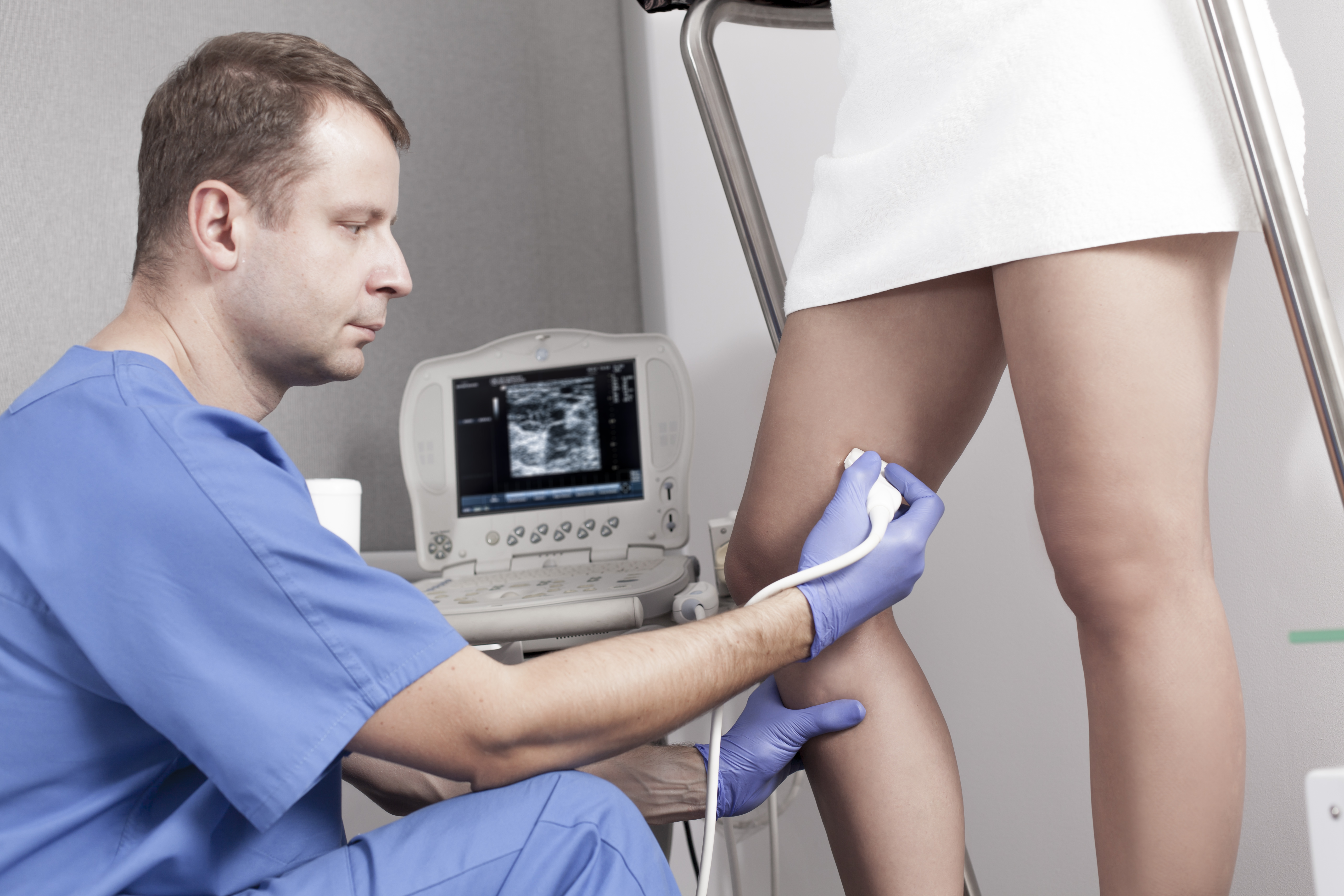
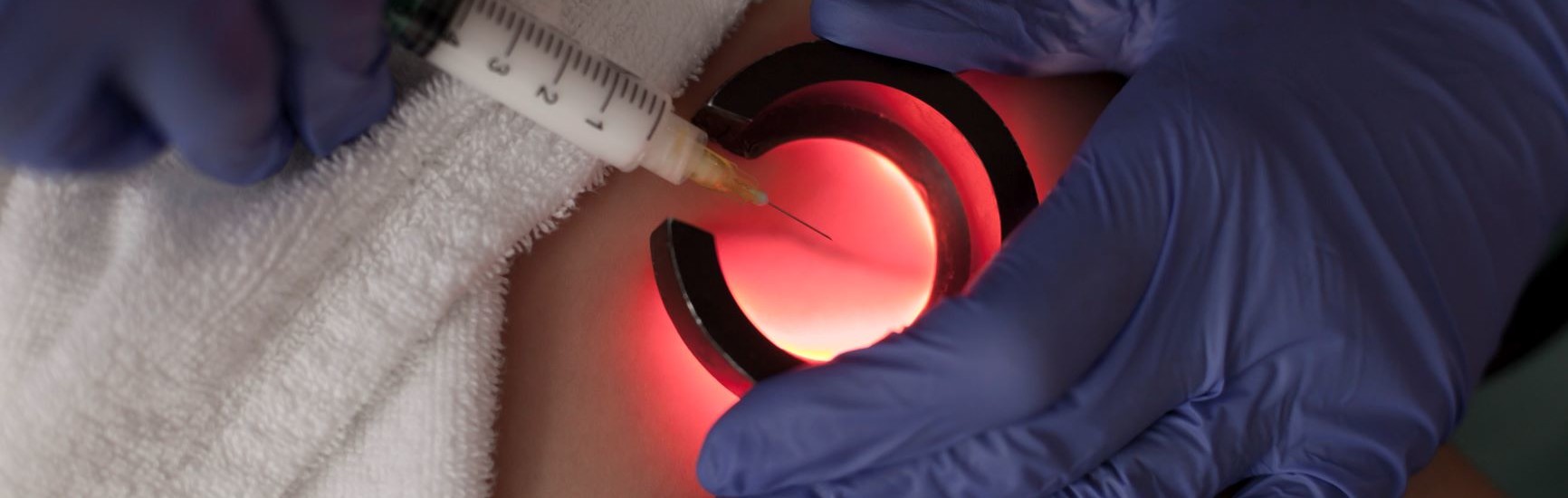
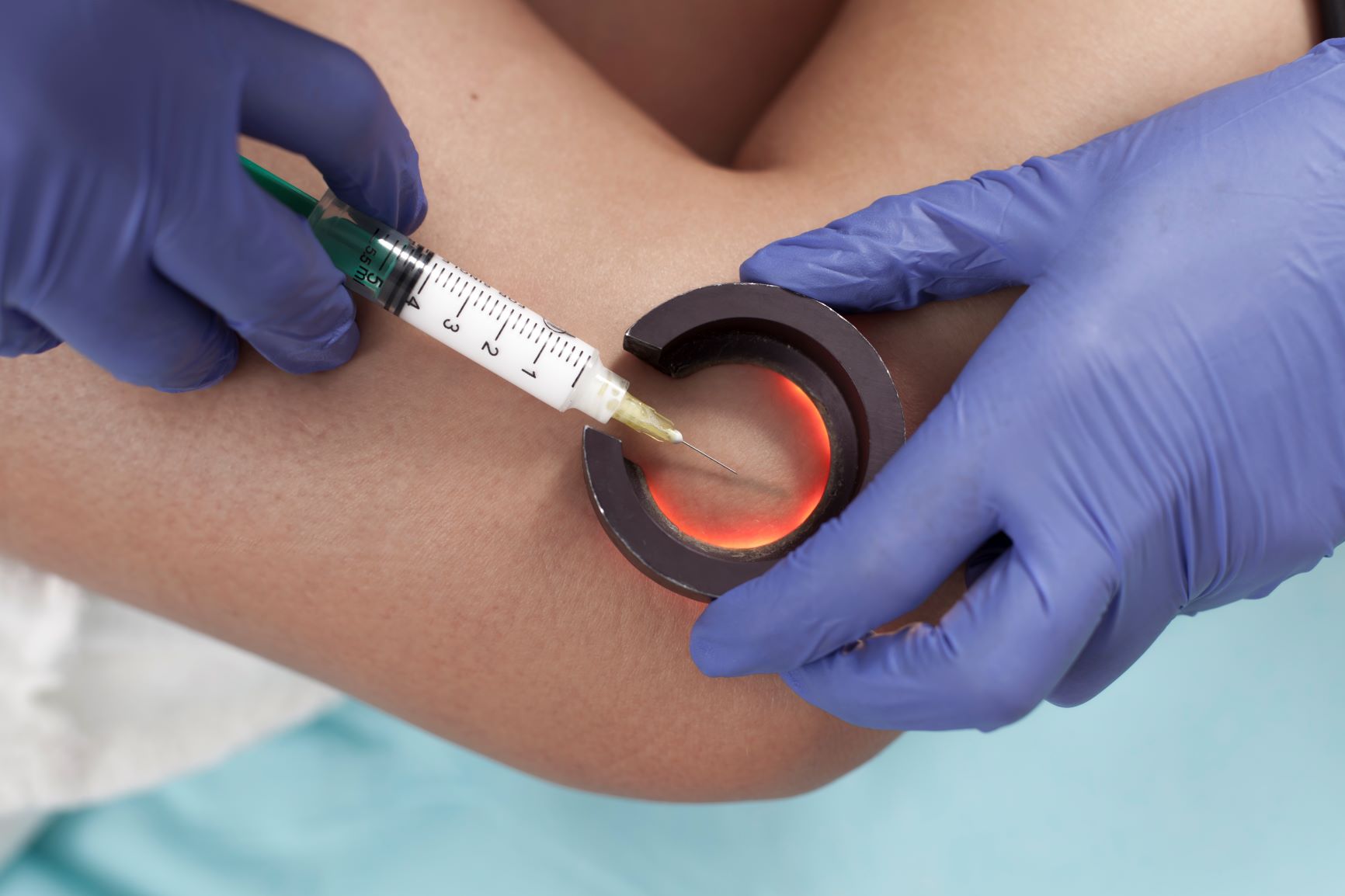
Zabieg nie wymaga znieczulenia, choć można przeprowadzić go również w miejscowej analgezji. W porównaniu do innych metod (chirurgicznych i EVLT) charakteryzuje się najłagodniejszym przebiegiem pod względem dolegliwości po zabiegu [13, 14] i znacznie mniejszymi kosztami.[15] Pod kontrolą USG zakłada się do niewydolnej żyły kaniulę. Tan i wsp. proponują w trakcie skleroterapii VSM stosowanie opaski uciskowej poniżej kolana, która zapobiegnie wypełnianiu się żyły, a następnie wprowadzenie wewnątrznaczyniowego cewnika przez kaniulę założoną nad opaską i podsunięcie go do odległości 1cm od ujścia VSM. Wprowadzanie sklerozantu do cewnika przy jego stopniowym wycofywaniu pozwala na precyzyjne wypełnienie żyły substancją, co można potwierdzić wizualizując pęcherzyki powietrza za pomocą USG. [6–8, 16] Skuteczność skleroterapii niewydolnej żyły odpiszczelowej po roku od zabiegu waha się od 60 do 80%, przy czym lepsze wyniki osiąga się w naczyniach o mniejszej średnicy (5mm i mniej) jak i stosując wyższe stężenia sklerozantu. [9, 10, 13, 17, 18] Wyleczenie refluksu w żyłach odpiszczelowych za pomocą skleroterapii poprawia funkcjonowanie układu żylnego i daje szansę na regresję zmian skórnych, które rozwinęły się w wyniku niewydolności. Pang i wsp. wykazali 81% wskaźnik gojenia się owrzodzeń żylnych u pacjentów poddanych temu zabiegowi. Średni czas gojenia wynosił u nich 6,5 miesiąca (w grupie kontrolnej 24 miesiące), a współczynnik nawrotów 5% w ciągu dwóch lat (40% w grupie kontrolnej). [19]
Kolejnym problemem klinicznym związanym z przewlekłą niewydolnością żylną jest izolowana niewydolność perforatorów, która stanowi przyczynę prawie 20% żylaków. Ponadto może manifestować się w postaci pozostałych objawów niewydolności żylnej tj. zmian skórnych, teleangiektazji, przebarwień i owrzodzeń. Według Kishore i wsp. skleroterapia niewydolnych perforatorów daje 60% skuteczności badanej po 6 miesiącach od zabiegu, a subiektywna poprawa dolegliwości jest porównywalna z efektami miniflebektomii. [20]
Najczęstszymi powikłaniami skleroterapii są powikłania miejscowe, takie jak zapalenie żył (<10%) i przebarwienia skórne (10-30% w ciągu 12 miesięcy od zabiegu), wynikające z prozapalnego działania sklerozantu. [21] Najbardziej niebezpiecznym powikłaniem miejscowym jest martwica tkanek. Dochodzi do niej rzadko (0,2-1,2%). Jeśli jest rozległa, to najprawdopodobniej jest związana z przypadkowym – dotętniczym podaniem sklerozantu. W razie wystąpienia takiej sytuacji, miejscowe podanie nitrogliceryny może wspomóc wazodylatację naczyń i zminimalizować potencjalne szkody. [22] Poważne powikłania, takie jak zakrzepica żył głębokich oraz zator tętnicy płucnej są rzadkie (<0,1%). Ponadto u osób z przetrwałym otworem owalnym zanotowano na świecie zaledwie kilka przypadków przemijających incydentów neurologicznych związanych z zatorowością.[23] Zakrzepica żył głębokich, nawet jeśli występuje, najczęściej ma przebieg bezobjawowy i rozpoznawana jest na podstawie kontrolnych badań USG. [8] Pierwotnie uważano, że powikłania te są konsekwencją przedostania się sklerozantu do układu głębokiego. Jednak dalsze badania udowodniły, że zawsze pewna część substancji ulegnie takiej migracji. Zjawisko można to jedynie ograniczać uciskając podczas skleroterapii miejsce ujścia do układu głębokiego.[24]
Badanie randomizowane Wright i wsp. wykazało ryzyko rozwoju zakrzepicy żył głębokich na poziomie 5,3% po wstrzyknięciu 60ml sklerozantu w postaci piany. Po zmniejszeniu dawki do 30ml powikłanie to przestało występować. Obecnie konsensus europejski zaleca ograniczenie do 10ml podczas jednego zabiegu. [18]
Wielu pacjentów chorujących na przewlekłą niewydolność żylną cierpi również na inne schorzenia internistyczne, których współistnienie istotnie zwiększa ryzyko operacji. Z tego powodu nie kwalifikują się do leczenia chirurgicznego. Jedyną alternatywą leczenia zachowawczego są u nich metody małoinwazyjne, szczególnie skleroterapia.[6, 8]
Co więcej, przewaga skleroterapii nad metodą laserową polega na tym, że można ją z powodzeniem stosować w przypadku żył krętych (w których sztywne włókno lasera nie może się poruszać) i biegnących płytko pod skórą (energia lasera mogłaby uszkodzić skórę). Za pomocą skleroterapii można zamykać naczynia różnego kalibru. Od teleangiektazji i żył siatkowatych (za pomocą aethoxysklerolu o stężeniu 0,5%), małych żylaków podskórnych (1%), po żylaki o średnicy 2-4mm (2%) i 4-8mm (3%).[10]
Zastosowanie skleroterapii w metodzie CLaCS
Metoda CLaCS to nowatorska metoda zamykania naczynek przy jednoczesnym użyciu laseroterapii i skleroterapii. Procedura nie byłaby możliwa bez pomocy urządzenia Vein Viewer, działającego na zasadzie rozszerzonej rzeczywistości, która umożliwia nam dostrzeżenie tego, co niewidzialne. Sama koncepcja terapii powstała po przeanalizowaniu zastosowania Vein Viewera. Urządzenie początkowo służyło bowiem do pobierania krwi. Dr. Kasuo Miyake wykorzystał zdolność urządzenia do lokalizowania żył, co umożliwiło mu poddać terapii również położone głębiej pod skórą żyły sieciowe, których leczenie było do tej pory ograniczone możliwościami ich obrazowania. Zwiększenie pola zabiegowego o naczynia znajdujące się na głębokości do 1.5 cm pod skórą to druga kwestia, która całkowicie wyróżnia metodę CLaCS od pozostałych. Umożliwia bowiem uzyskanie lepszych efektów terapii. Ma to o tyle duże znaczenie, że wspomniane żyły sieciowe zasilają naczynka, które prześwitują przez skórę, zatem samo zamknięcie tych naczyń często nie przynosiło w pełni zadowalających rezultatów. Trzecia kwestia to skrócenie trwania całego procesu leczenia. Co prawda czas jednej sesji jest dużo dłuższy od standardowych procedur, natomiast dzięki jednoczesnemu zastosowaniu skleroterapii i lasera oraz dokładnej wizualizacji żył, które chcemy zamknąć, liczba sesji jest mniejsza, stąd też szybciej uzyskamy pożądany efekt.
Procedura CLaCS opiera się na zamknięciu nie tylko widocznych teleangiektazji oraz wenulektazji, ale także niewidocznych gołym okiem żył sieciowych, których obraz możemy uzyskać jedynie za pomocą Vein Viewera. W pierwszej kolejności zamykamy warstwę naczyń znajdującą się najpłycej. Są to zazwyczaj drobne teleangiektazje koloru czerwonego lub sinofioletowego. Następnie zamykamy żyły o nieco większej średnicy, leżące głębiej. W pierwszym przypadku używamy odpowiednio dobranej laseroterapii, w drugim zaś skleroterapię w postaci płynu bądź piany o określonym stężeniu. Cały zabieg odbywa się przy jednoczesnym chłodzeniu obszaru poddawanego zabiegowi. Vein Viewer wykorzystuje nieszkodliwe światło podczerwieni, dzięki któremu dokładnie określa położenie żył na głębokości 3-15 mm, a następnie wyświetla ja na nodze pacjenta. Taka sesja trwa około 30 minut. Po zabiegu pacjent może wrócić do codziennych zajęć.
Bibliografia
1. Margolis DJ, Bilker W, Santanna J, Baumgarten M. Venous leg ulcer: Incidence and prevalence in the elderly. J Am Acad Dermatol. 2002;46:381–6.
2. Rasmussen LH, Lawaetz M, Bjoern L, Vennits B, Blemings A, Eklof B. Randomized clinical trial comparing endovenous laser ablation, radiofrequency ablation, foam sclerotherapy and surgical stripping for great saphenous varicose veins. Br J Surg. 2011;98:1079–87. doi:10.1002/bjs.7555.
3. Raju S, Hollis K, Neglen P. Use of compression stockings in chronic venous disease: Patient compliance and efficacy. Ann Vasc Surg. 2007;21:790–5. doi:10.1016/j.avsg.2007.07.014.
4. Gohel MS, Barwell JR, Taylor M, Chant T, Foy C, Earnshaw JJ, et al. Long term results of compression therapy alone versus compression plus surgery in chronic venous ulceration (ESCHAR): Randomised controlled trial. BMJ. 2007;335:83. doi:10.1136/bmj.39216.542442.BE.
5. Neto FC, Araújo GR de, Kessler IM, Amorim RFB de, Falcão DP. Treatment of severe chronic venous insufficiency with ultrasound-guided foam sclerotherapy: A two-year series in a single center in Brazil. Phlebology. 2015;30:113–8. doi:10.1177/0268355513517225.
6. de-Abreu GCG, Camargo Od, de-Abreu MFM, de-Aquino JLB. Ultrasound-guided foam sclerotherapy for severe chronic venous insufficiency. Rev Col Bras Cir. 2017;44:511–20. doi:10.1590/0100-69912017005014.
7. Darvall KAL, Bate GR, Adam DJ, Silverman SH, Bradbury AW. Duplex ultrasound outcomes following ultrasound-guided foam sclerotherapy of symptomatic primary great saphenous varicose veins. Eur J Vasc Endovasc Surg. 2010;40:534–9. doi:10.1016/j.ejvs.2010.06.020.
8. Tan VKM, Abidin SZ, Tan SG. Medium-term results of ultrasonography-guided, catheter-assisted foam sclerotherapy of the long saphenous vein for treatment of varicose veins. Singapore Med J. 2012;53:91–4.
9. Bradbury AW, Bate G, Pang K, Darvall KA, Adam DJ. Ultrasound-guided foam sclerotherapy is a safe and clinically effective treatment for superficial venous reflux. J Vasc Surg. 2010;52:939–45. doi:10.1016/j.jvs.2010.04.077.
10. Darwood RJ, Theivacumar N, Dellagrammaticas D, Mavor AID, Gough MJ. Randomized clinical trial comparing endovenous laser ablation with surgery for the treatment of primary great saphenous varicose veins. Br J Surg. 2008;95:294–301. doi:10.1002/bjs.6101.
11. Yamaki T, Nozaki M, Iwasaka S. Comparative study of duplex-guided foam sclerotherapy and duplex-guided liquid sclerotherapy for the treatment of superficial venous insufficiency. Dermatol Surg. 2004;30:718-22; discussion 722. doi:10.1111/j.1524-4725.2004.30202.x.
12. Hinchliffe RJ, Ubhi J, Beech A, Ellison J, Braithwaite BD. A prospective randomised controlled trial of VNUS closure versus surgery for the treatment of recurrent long saphenous varicose veins. Eur J Vasc Endovasc Surg. 2006;31:212–8. doi:10.1016/j.ejvs.2005.07.005.
13. Venermo M, Saarinen J, Eskelinen E, Vähäaho S, Saarinen E, Railo M, et al. Randomized clinical trial comparing surgery, endovenous laser ablation and ultrasound-guided foam sclerotherapy for the treatment of great saphenous varicose veins. Br J Surg. 2016;103:1438–44. doi:10.1002/bjs.10260.
14. Campos W, Torres IO, da Silva ES, Casella IB, Puech-Leão P. A prospective randomized study comparing polidocanol foam sclerotherapy with surgical treatment of patients with primary chronic venous insufficiency and ulcer. Ann Vasc Surg. 2015;29:1128–35. doi:10.1016/j.avsg.2015.01.031.
15. Marsden G, Perry M, Bradbury A, Hickey N, Kelley K, Trender H, et al. A Cost-effectiveness Analysis of Surgery, Endothermal Ablation, Ultrasound-guided Foam Sclerotherapy and Compression Stockings for Symptomatic Varicose Veins. Eur J Vasc Endovasc Surg. 2015;50:794–801. doi:10.1016/j.ejvs.2015.07.034.
16. Tan VKM, Tan SG. Technique and early results of ultrasound-guided foam sclerotherapy of the long saphenous vein for treatment of varicose veins. Singapore Med J. 2009;50:284–7.
17. Brittenden J, Cotton SC, Elders A, Tassie E, Scotland G, Ramsay CR, et al. Clinical effectiveness and cost-effectiveness of foam sclerotherapy, endovenous laser ablation and surgery for varicose veins: Results from the Comparison of LAser, Surgery and foam Sclerotherapy (CLASS) randomised controlled trial. Health Technol Assess. 2015;19:1–342. doi:10.3310/hta19270.
18. D Wright, J P Gobin, A W Bradbury, P Coleridge-Smith, H Spoelstra, D Berridge, C H A Wittens, A Sommer, O Nelzen, D Chanter, The Varisolve® European Phase III Investigators Group. Varisolve® polidocanol microfoam compared with surgery or sclerotherapy in the management of varicose veins in the presence of trunk vein incompetence: European randomized controlled trial. Phlebology. 2006;21:180–90. doi:10.1258/026835506779115807.
19. Pang KH, Bate GR, Darvall KAL, Adam DJ, Bradbury AW. Healing and recurrence rates following ultrasound-guided foam sclerotherapy of superficial venous reflux in patients with chronic venous ulceration. Eur J Vasc Endovasc Surg. 2010;40:790–5. doi:10.1016/j.ejvs.2010.08.011.
20. Kishore R, Sankar TB, Anandi A, Nedunchezhian S, Murugan V. A Prospective Study in Comparison of Ambulatory Phlebectomy and Duplex Guided Foam Sclerotherapy in the Management of Varicosities with Isolated Perforator Incompetence. Indian J Surg. 2016;78:356–63. doi:10.1007/s12262-016-1481-2.
21. Scurr JR, Gilling-Smith GL, Fisher RK. Systematic review of foam sclerotherapy for varicose veins (Br J Surg 2007; 94: 925-936). Br J Surg. 2007;94:1307-8; author reply 1308. doi:10.1002/bjs.6037.
22. Mwipatayi BP, Western CE, Wong J, Angel D. Atypical leg ulcers after sclerotherapy for treatment of varicose veins: Case reports and literature review. Int J Surg Case Rep. 2016;25:161–4. doi:10.1016/j.ijscr.2016.06.024.
23. Sarvananthan T, Shepherd AC, Willenberg T, Davies AH. Neurological complications of sclerotherapy for varicose veins. J Vasc Surg. 2012;55:243–51. doi:10.1016/j.jvs.2011.05.093.
24. Ceulen RPM, Jagtman EA, Sommer A, Teule GJJ, Schurink GWH, Kemerink GJ. Blocking the saphenofemoral junction during ultrasound-guided foam sclerotherapy– assessment of a presumed safety-measure procedure. Eur J Vasc Endovasc Surg. 2010;40:772–6. doi:10.1016/j.ejvs.2010.08.010.
25. Darvall KAL, Bate GR, Adam DJ, Silverman SH, Bradbury AW. Duplex ultrasound outcomes following ultrasound-guided foam sclerotherapy of symptomatic recurrent great saphenous varicose veins. Eur J Vasc Endovasc Surg. 2011;42:107–14. doi:10.1016/j.ejvs.2011.03.010.
26. Schul MW, Eaton T, Erdman B. Compression versus sclerotherapy for patients with isolated refluxing reticular veins and telangiectasia: A randomized trial comparing quality-of-life outcomes. Phlebology. 2011;26:148–56. doi:10.1258/phleb.2010.009092.
27. National Clinical Guideline Centre (UK). Varicose Veins in the Legs: The Diagnosis and Management of Varicose Veins.: National Institute for Health and Care Excellence (UK); 2013.