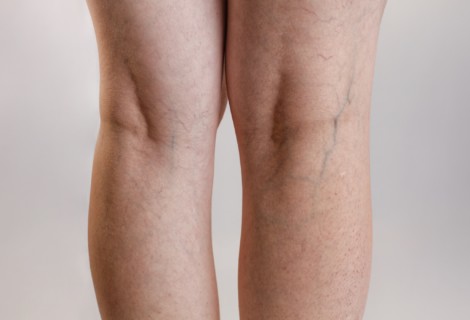
Słownik pojęć flebologicznych (część II)
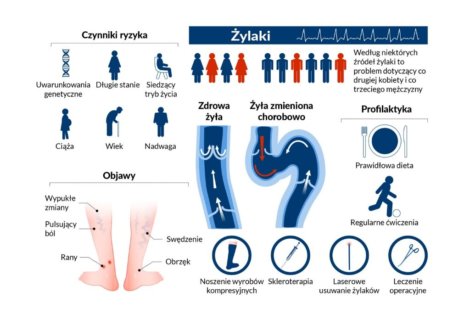
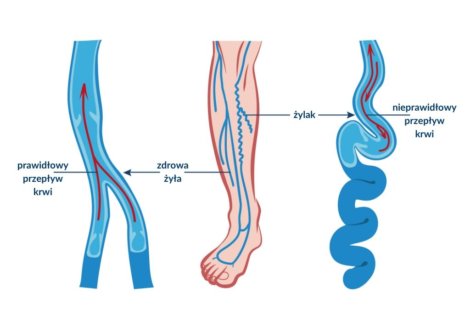
Słownik pojęć flebologicznych to przydatne źródło informacji dla pacjentów borykających się z problemem niewydolności żylnej. Takich, którym zależy na zrozumieniu źródła chorób układu żylnego kończyn dolnych. Z artykułu dowiecie się między innymi czym są wenulektazje i teleangiektazje, jak rozpoznawać owrzodzenia żylne i dlaczego tak ważna dla pacjentów z niewydolnością żylną jest kompresjoterapia.
Więcej